1 生化学的異常
生化学的特徴としては,中枢神経系だけでなく,ほとんどの組織や血漿,赤血球膜,白血球において,スフィンゴミエリン,ガングリオシドなどのスフィンゴ脂質の構成脂肪酸で飽和極長鎖脂肪酸の増加が認められる.従って、血漿中の飽和極長鎖脂肪酸(C26:0, C25:0,C24:0含量ならびにC22:0との比)の増加がALDの診断マーカーとして広く利用されている.但し、ALD患者の血漿あるいは線維芽細胞における飽和極長鎖脂肪酸の蓄積量と臨床的な病型や症状の進行に相関性はない.
一方で、細胞内の飽和極長鎖脂肪酸量は,その生合成によっても影響を受けるため、ALDの第一義的な生化学的異常は飽和極長鎖脂肪酸のβ酸化不全であるが,ALD患者の線維芽細胞では長鎖脂肪酸から飽和極長鎖脂肪酸への生合成が亢進されているとの報告がある1, 2).実際,細胞内で増加したVLCFA-CoAは,elongase: elongation of very long chain fatty acids(ELOVL1)によって,さらに脂肪酸の炭素鎖長が伸長され3),このELOVL1を患者細胞内でノックダウンさせることにより,飽和極長鎖脂肪酸の伸長反応を減少させC26:0を低下させることが可能である3).
2 脱髄の発症機序
ALDの生化学的特徴は飽和極長鎖脂肪酸の蓄積であるが,脱髄に至る過程は不明である.大脳型ALDでは神経病理学的には大脳白質のびまん性脱髄が特徴で,U線維と皮質下白質のミエリンは比較的保たれている.病変部位は組織像から脱髄層,炎症層,壊死層の3つの層に分けられる4).また,脳MRIでのT1強調画像でも病理像を反映して,低信号で造影効果を認めない辺縁の脱髄層と中心の壊死層の中間に,線状に造影される炎症層が認められる(図1).
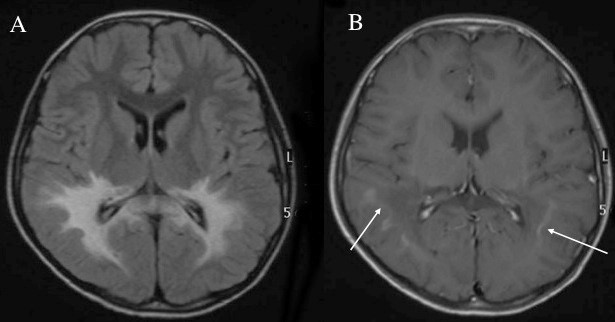
図1.大脳型MRI画像
A:FLAIR像.両側後頭葉に高信号域を認める.
B:T1強調画像.病変の中心部は低信号を呈するが,その外側(矢印)にガドリニウムにて線状の造影効果を認める.
脱髄に至る病態の仮説としては,ABCD1の機能不全により蓄積した飽和極長鎖脂肪酸が引き金となり,ミエリンの物理的不安定,酸化ストレスの誘導とミトコンドリアの機能障害,脂質抗原の提示による免疫系の変動等を介して,ミクログリアからの炎症性サイトカインの産生誘導などが考えられている5).
3 AMNとabcd1ノックアウトマウス
CCALDに比べAMN患者では剖検時の進行状況にもよるが,脊髄病変として脱髄に加えて軸索の著明な脱落を認めるものの,炎症細胞の浸潤は乏しい4).一方,ALDモデルであるabcd1ノックアウトマウスでは,脳,脊髄,肺,腎での飽和極長鎖脂肪酸の蓄積や,線維芽細胞や肝細胞での飽和極長鎖脂肪酸β酸化活性の低下は認めたが,当初,脳,脊髄,末梢神経での異常は認められなかった6-8).しかし,その後,15月齢以降に神経行動異常や神経伝導速度の遅延,脊髄,末梢神経でのミエリンや軸索の異常が報告されている8).abcd1ノックアウトマウスの基本病態はAMNであり,ALD患者では何らかの因子が加わることにより大脳型を発症する可能性が考えられている.したがって,大脳型の発症因子を解明する手段として, abcd1ノックアウトマウスにおける大脳型発症への取組みは病態解明だけでなく,治療開発モデルとして重要と思われる.最近の研究ではabcd1ノックアウトマウスにおける軸索変性に酸化ストレスが関与する可能性も示唆されている9, 10).
1)Tsuji S, Ohno T, Miyatake T, et al: Fatty acid elongation activity in fibroblasts from patients with adrenoleukodystrophy (ALD). J Biochem 1984; 96: 1241-1247.
2)Kemp S, Valianpour F, Denis S, et al: Elongation of very long chain fatty acids is enhanced in X-linkedadrenoleukodystrophy. Mol Genet Metab 2005; 84: 144-151.
3)Ofman R, Dijkstra IM, van Roermund CW, et al: The role of ELOVL1 in very long-chain fatty acid homeostasis and X-linked adrenoleukodystrophy. EMBO Mol Med 2010; 2: 90-97.
4)宮武 正:ペルオキシソームと神経疾患.科学評論社,1989:103-117.
5)Morita M, Shimozawa N, Kashiwayama Y, et al: ABC subfamily D proteins and very long chain fatty acid metabolism as novel targets in adrenoleukodystrophy. Curr Drug Targets 2011; 12: 694-706.
6)Kobayashi T, Shinnoh N, Kondo A, et al: Adrenoleukodystrophy protein-deficient mice represent abnormality of very long chain fatty acid metabolism. Biochem Biophys Res Commun 1997; 232: 631-636.
7)Lu J, Lawler AM, Watkins PA, et al: A mouse model for X-linked adrenoleukodystrophy. Proc Natl Acad Sci USA 1997; 94: 9366-9371.
8)Pujol A, Hindelang C, Callizot N, et al: Late onset neurological phenotype of the X-ALD gene inactivation in mice: a mouse model for adrenomyeloneuropathy. Hum Mol Genet 2002; 11: 499-505.
9)Galea E, Launay N, Portero-Otin M, et al: Oxidative stress underlying axonal degeneration in adrenoleukodystrophy: A paradigm for multifactorial neurodegenerative diseases? Biochim Biophys Acta 2012; 1822: 1475-1488.
10)López-Erauskin J, Fourcade S, Galino J, et al: Antioxidants halt axonal degeneration in a mouse model of X-adrenoleukodystrophy. Ann Neurol 2011; 70: 84-92.