研究内容
(1)グライコプロテオミクスの自動前処理装置とその要素技術の開発
近年、ゲノミクス(核酸)、プロテオミクス(タンパク質)を基盤にグライコミクス(糖鎖)という新次元のオミックスを加えた統合的な解析が求められています。タンパク質の約60%には糖鎖が結合しています。よって糖鎖変化の情報と、キャリア―タンパク質の情報を同時に取得ができるグライコプロテオミクスは重要な解析アプローチです。このグライコプロテオームを含む糖鎖ビックデータの構築には、より多くのコホートから個々の糖鎖情報を得ることが必要となります。そこで我々は、いつ・どこにいても「均質な糖鎖データ」が収集できるように、オートマティックかつ迅速に分析できる解析基盤を構築しています。
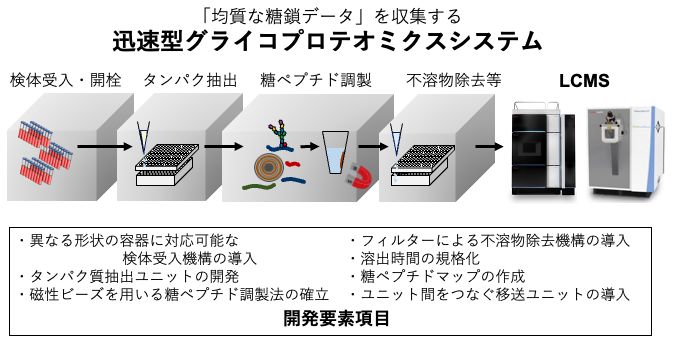
例えば、血漿グライコプロテオミクスは、数十工程からなる複雑な工程によって行われます(右図)。これらの工程にはタンパク質の抽出、還元アルキル化、トリプシン消化、糖ペプチド濃縮、高速液体クロマトグラフー質量分析計(LC-MS)による分析などを含みます。本工程をロボット作業に細分化すると、溶液の添加や撹拌、液液抽出、集磁、遠心分離、超音波処理などがあり、これらのステップを途切れることなく行うことは極めて困難です。またグライコプロテオームの膨大なデータを処理するうえで、糖ペプチド情報のマッピングやデータベースの構築が必要不可欠です。さらに検体のバーコード管理など、堅牢なサンプルトレーサビリティを管理して臨床情報と紐づけることも重要です。我々は、それら実現するため最先端の要素技術を導入して、ロボティクスとシステム統合した自動機開発を企業連携によって進めています。具体的には、抗体カラムによるタンパク質抽出や新規HILIC磁性ビーズなどを開発、“世界標準のプロトコル”を発信してヒューマングライコームプロジェクトの大規模コホート展開を推進していきます。
(2)糖ヌクレオチドを中心としたメタボロミクスによる糖鎖―代謝連関の解明
グルコースが細胞内に取り込まれると、約95%は解糖系を経てエネルギー産生に用いられますが、その一部は糖ヌクレオチドの合成に用いられます。この糖ヌクレオチドは単糖の活性型フォームであり、糖転移酵素のドナー基質として糖鎖修飾に必須な分子です。糖鎖修飾の制御において、糖転移酵素の発現量や活性、局在が与える影響は大きいことが知られていますが、その他の制御因子として、糖ヌクレオチドや糖関連メタボライトも関係します(Shirato et al. J.Clin.Biochem.Nutr. 2011)。以上のような理由で、我々はこれらの一斉定量法を確立し、プロトコルのアップデートをしてきました(右図:参考文献)。
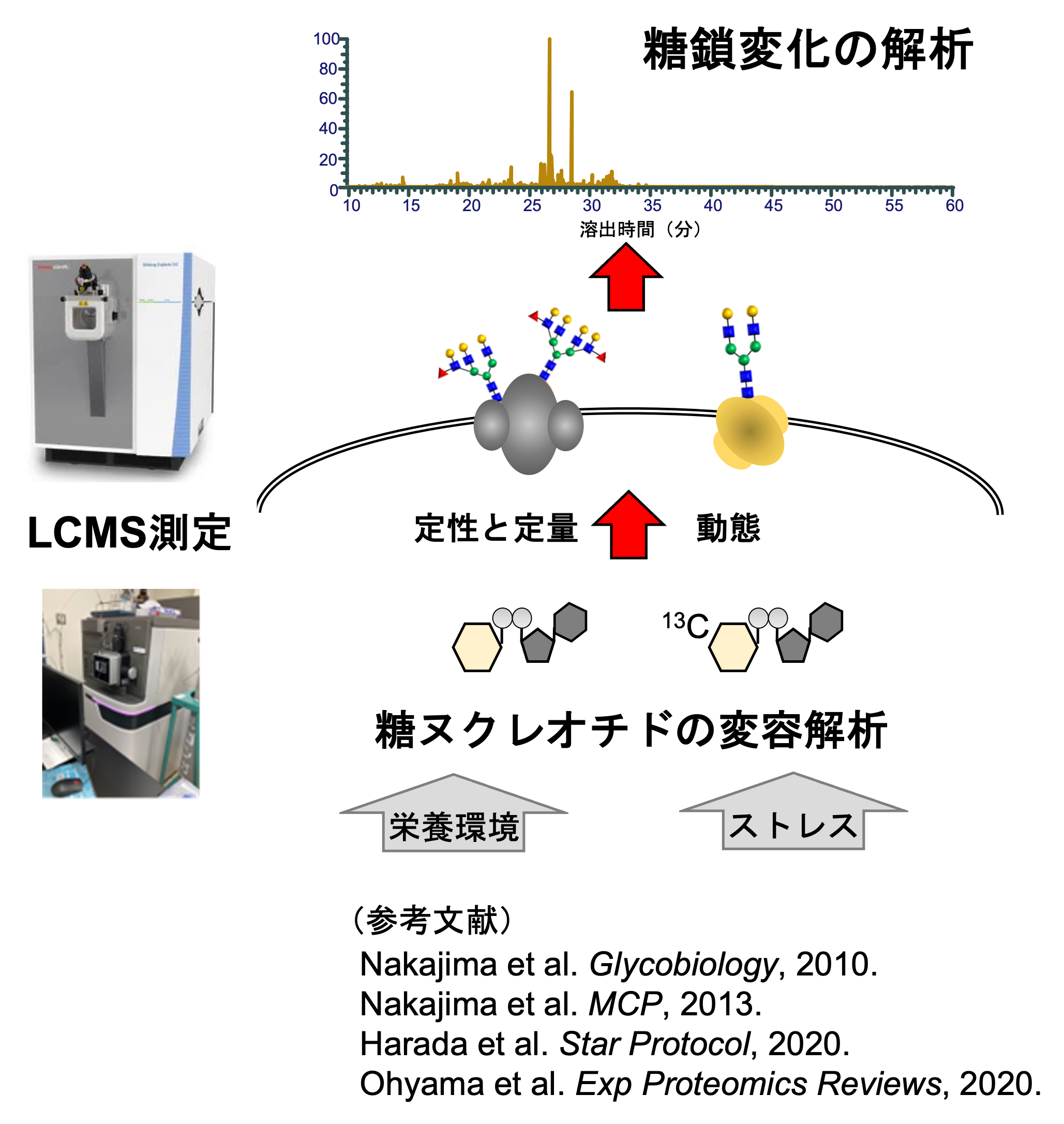
また近年、O-マンノースやO-フコース型糖鎖、C-マンノース型糖鎖、さらに糖鎖RNAや新規な遊離糖鎖など、様々な糖鎖の存在と機能が明らかになりました。このような希少糖鎖の生合成には、未解明な生合成経路が存在すると考えられ、その生合成において新しい糖鎖―糖ヌクレオチド代謝連関が存在すると我々は考えています。最近では高感度LC-MSを用いて、哺乳類脳組織にUDP-マンノースが存在することを明らかにしました(Nakajima et al. BBRC, 2018)。また共同研究をつうじて、非天然型のGDP-2-デオキシマンノースがN型糖鎖の分解を誘導して、細胞外小胞の分泌を抑えるという発見にも貢献しました(Harada et al. Cell Report, 2020)。我々はこういった新たな代謝連関を探るために分析技術の開発を行い、さらにグライコミクスやイメージングなども取り入れて糖鎖機能の解明を進めます。本研究によって、これまで個別に進められていたメタボロミクスとグライコミクスを架け橋する新領域のオミックス解析学を開拓していきます。
糖ヌクレオチドの分析については、フランス リール大学、カナダ ラバル大学、名古屋大学、岐阜大学の研究者と共同研究を進めています。
(3)嚢胞性腎疾患群など腎疾患の糖ペプチドマーカーに関する研究
嚢胞性腎疾患群は、非がん性の細胞増殖亢進性の遺伝性疾患です。最近、2-デオキシグルコースなどの単糖代謝阻害剤が新たな治療標的として着目されています。我々はその糖鎖―代謝連関を介する病態メカニズムを明らかにするため、病態モデルを用いた基礎研究を続けてきました。最近では、糖尿病性腎臓病にも着目し、多様な病変を識別するためのシアリル化糖ペプチドマーカーも探っています。本研究は主に藤田医科大学との共同で進めています。
他、腎疾患とN型糖鎖の関連についてはiGOCREの木塚康彦教授と共同研究を行っています。
(4)尿中糖鎖バイオマーカーに関する研究

尿検体は侵襲性の低さから実臨床応用がしやすい臨床検体です。我々は尿中の微量分子を対象にした脂質性バイオマーカー探索基盤を構築し、糸球体性疾患を罹患した患者尿のリピドミクスにおいてリゾホスファチジルコリンが変動することが明らかにしました(右図)。引き続き、糖タンパク質や遊離糖鎖なども対象にして腎疾患のバイオマーカー探索を進めていきます。遊離糖鎖の研究は、当研究室の半澤研究員と大阪国際がんセンターとの共同で行っています。
(5)ストレスに伴って生じる糖脂質や糖タンパク質の変動解析
神経変性疾患や老化などを対象にして、LC-MSを用いて糖鎖変化を解析しています。ストレスに伴って生じる糖鎖変化が病態を抑制するという説を、生化学や神経細胞生物学的なアプローチによって解析しています。
(6)認知症等、病態モデルにおけるグライコプロテオームとその標準糖鎖データの取得
認知症や老化におけるヒューマングライコームの裏付けには、標準糖鎖データを取得することが重要です。例えば患者―健常人間の比較だけでなく、健常人における経年変化や、年齢および性差の影響、食習慣などの電子データと追跡することが必要です。我々は神経疾患に既往歴がない患者の髄液などをコントロール試料として、年齢、性別ごとの糖脂質発現量を検討しています。
一方、病態メカニズムの解明では、病態モデル動物やモデル細胞を用いた解析が必須です。病態モデル動物を作出している異分野研究者と積極的に共同研究を進めていきます。