研究内容
N型糖鎖の枝分かれ構造の機能研究
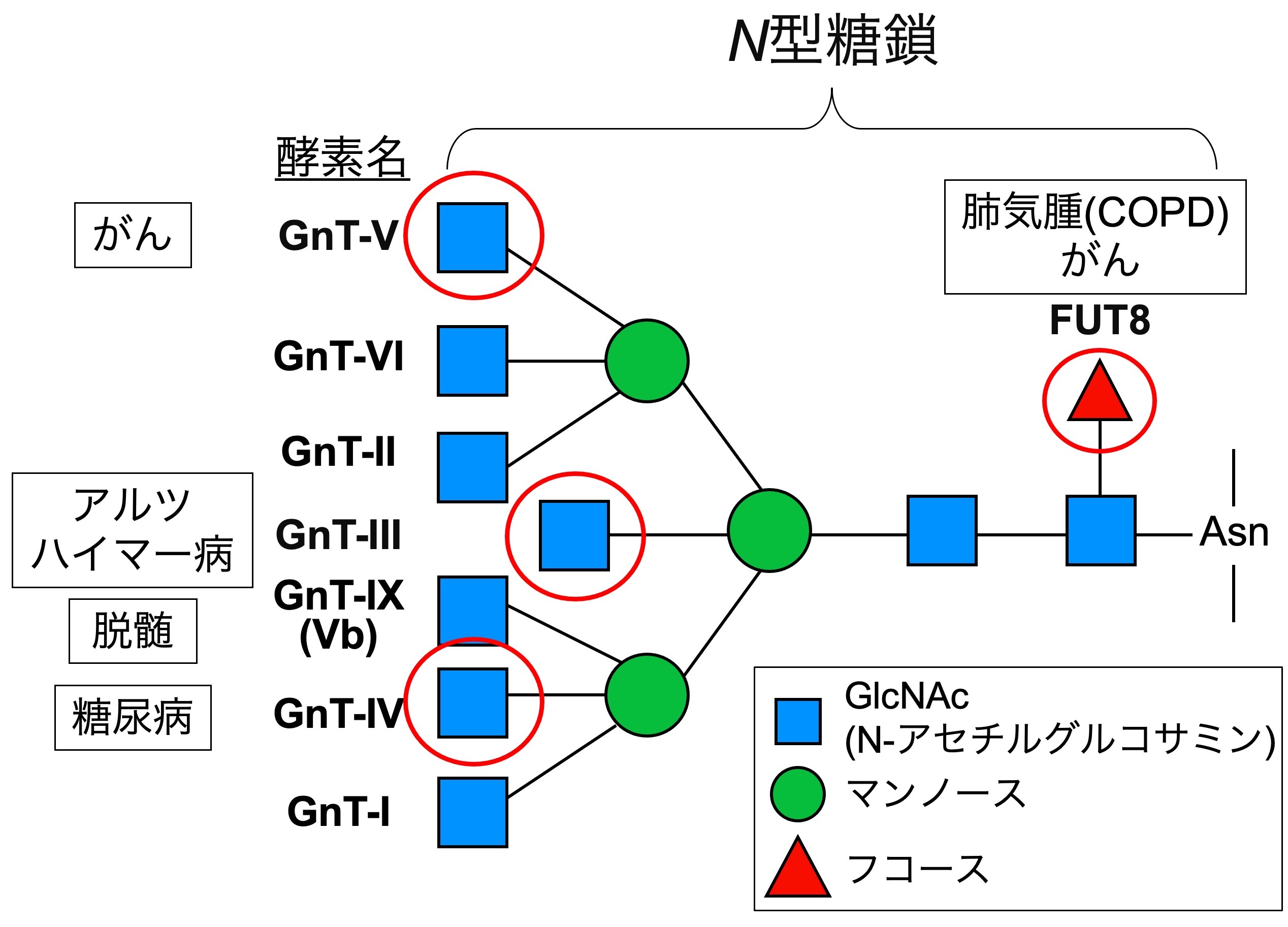
図1. N型糖鎖の枝分かれ構造と生合成酵素、疾患との関連性
当研究室では、タンパク質に結合したN型糖鎖の発現・機能・疾患との関わりを研究しています。中でも、糖鎖の枝分かれ構造に着目しています。
N型糖鎖は、タンパク質の普遍的な糖鎖修飾で、様々な構造のバリエーションを持っています。特に、2から5つ程度の枝分かれ構造があることが特徴です。それぞれの糖の枝には固有の機能があり、特定の疾患に関わることがわかってきています(図1)。さらに、それぞれの枝にはタンパク質選択性があり、特定の枝を持った糖鎖は限られたタンパク質にしかつきません。ところが、それぞれの糖鎖の枝が機能を発揮する分子メカニズムや、タンパク質選択性が生み出されるメカニズムについてはほとんどわかっていません。
当研究室では、枝分かれ構造の生合成を担う酵素(糖転移酵素)に着目して、これらの疑問に取り組んでいます。最終的には、これらの糖鎖が関連する疾患の治療につながることを目指しています。
アルツハイマー病を進行させるバイセクト糖鎖(bisecting GlcNAc)の研究
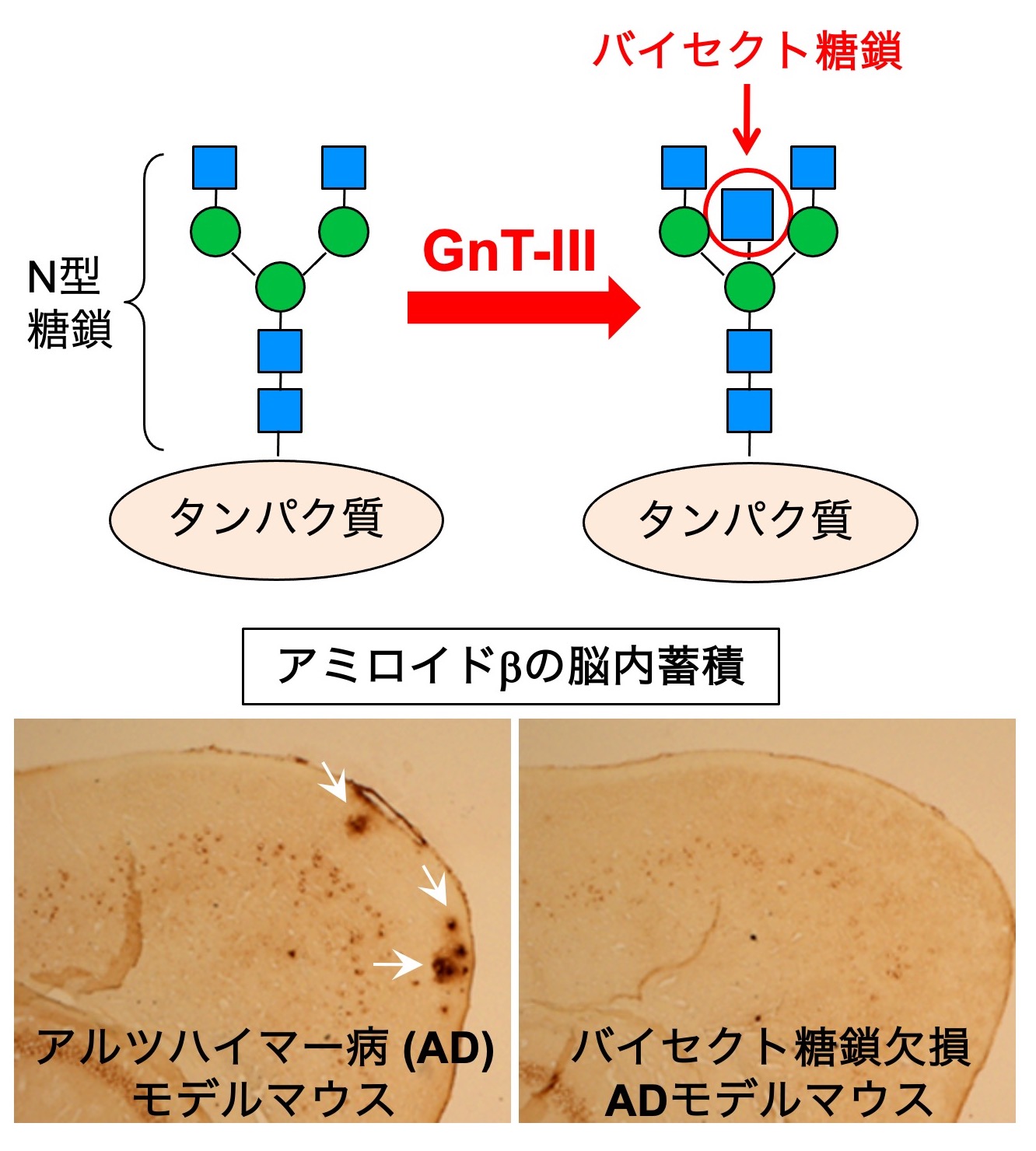
図2. (上) バイセクト糖鎖の構造と生合成酵素(下) アルツハイマー病のモデルマウスの脳に蓄積するアミロイドβ。バイセクト糖鎖欠損マウスではアミロイドβが激減する。
(参考文献:Kizuka et al., EMBO Mol. Med., 2015)
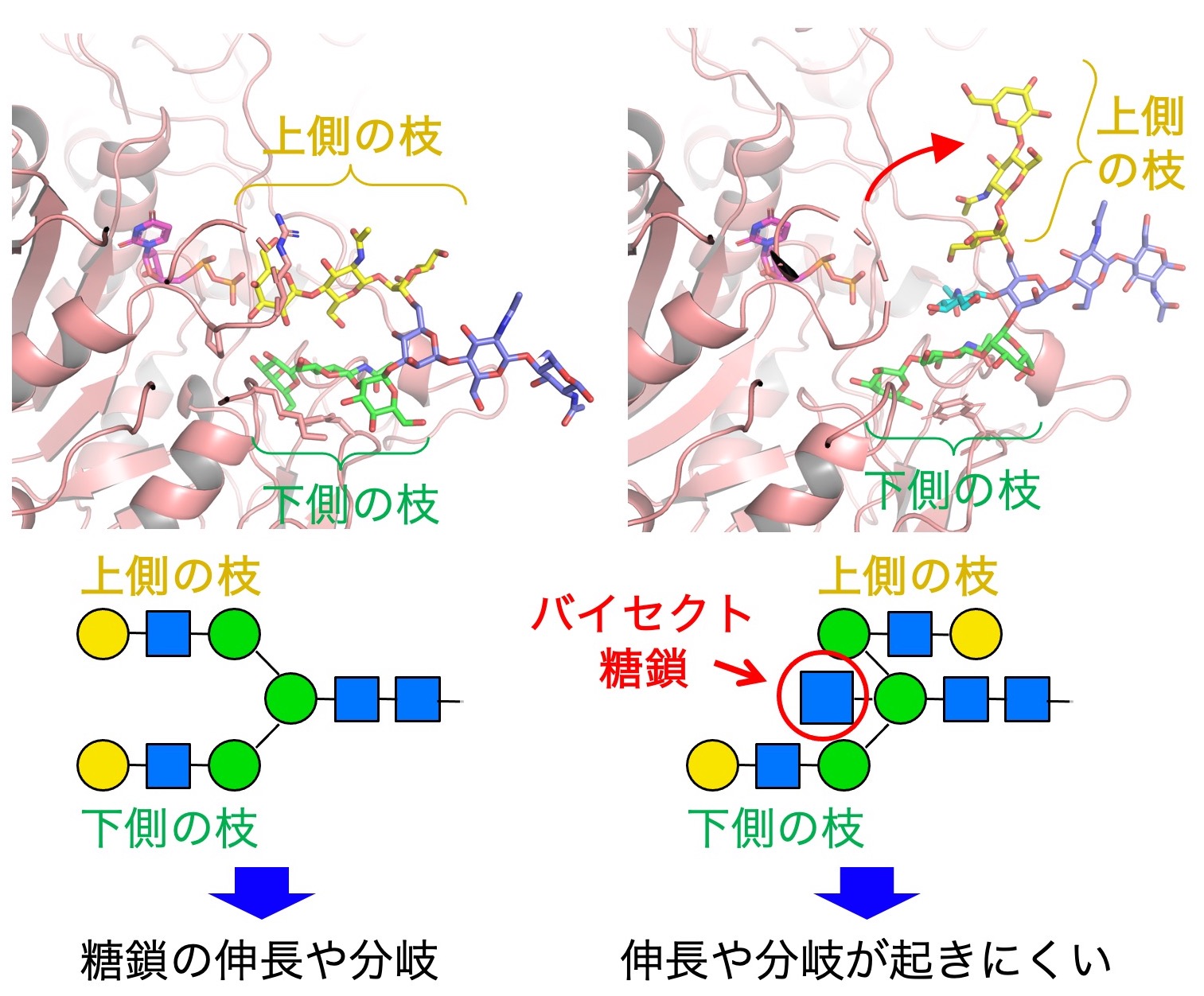
図3. バイセクト糖鎖があると、糖鎖の上側の枝の形が変化する。この変化によって、糖鎖の伸長やさらなる枝分かれなどが阻害され、複雑な糖鎖が作られにくくなる。
(参考文献:Nakano et al., Mol. Cell. Proteomics., 2019)
N型糖鎖の枝分かれ構造の一つに、バイセクト糖鎖(bisecting GlcNAc)という構造があります(図2上)。この枝分かれを持った糖鎖は、アルツハイマー病の発症や進行と深い関係があることがわかってきました。アルツハイマー病の原因はアミロイドβと呼ばれるペプチドが脳に蓄積することですが、この糖鎖を欠損したマウスでは、アミロイドβが作られなくなって症状が軽くなることがわかりました(図2下)。それは、アミロイドβを作る酵素であるBACE1がこの糖鎖を持っており、BACE1の機能がバイセクト糖鎖によって正に調節されているためです。さらに、アルツハイマー病の患者の脳ではバイセクト糖鎖の発現量が増加していることから、この糖鎖はアルツハイマー病の進行に関与することが示唆されています。しかし一方で、バイセクト糖鎖によってBACE1の機能が分子レベルでどのように調節されているのかその多くは謎のままです。 現在、この仕組みの解明に向けた実験やバイセクト糖鎖を合成する酵素GnT-IIIの阻害剤の探索などを行っています。
またバイセクト糖鎖の持つ本来の生理機能についての研究も行っています。バイセクト糖鎖の3次元構造を調べたところ(図3)、通常の糖鎖と比較して、バイセクト糖鎖では糖鎖の上側の枝が反対方向に向きやすいことがわかりました(図3右)。通常は糖鎖がさらに伸長したり枝分かれしますが、バイセクト糖鎖では、この反転によりそのような伸長や枝分かれが起きにくいことがわかりました。つまり、バイセクト糖鎖ができることによって、複雑な糖鎖ができにくくなることから、バイセクト糖鎖はN型糖鎖全体の生合成を抑える働きがあることがわかりました。
現在、バイセクト糖鎖が高発現するニューロンや腎臓での役割、またGnT-IIIの機能を調節するメカニズムなどについても研究を行っています。
がんを悪性化させるβ1,6分岐構造の研究
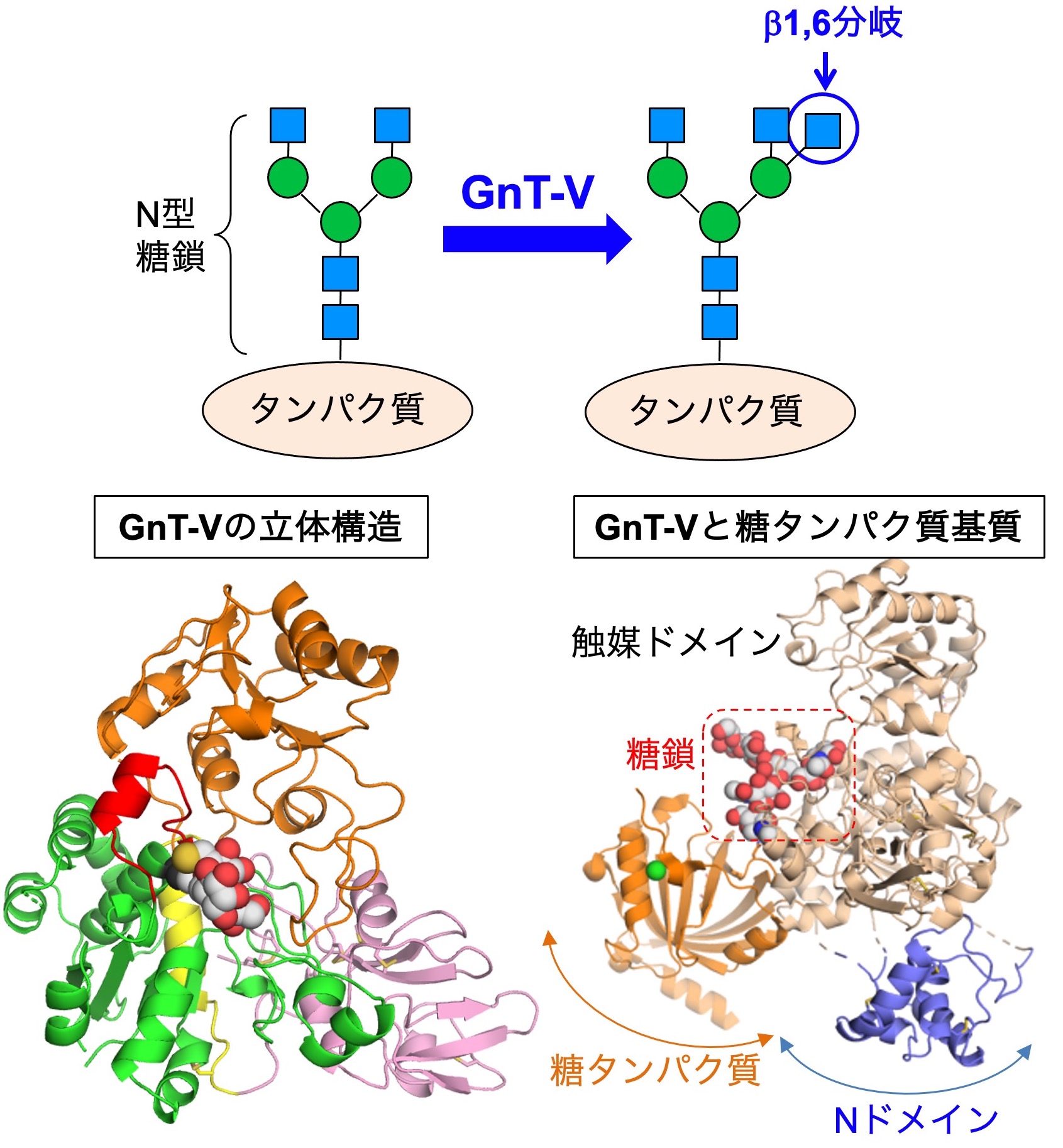
図4. (上) β1,6分岐構造と生合成酵素 (下) GnT-Vの立体構造
(参考文献:Nagae et al., Nat. Commun., 2018)
(参考文献:Osuka et al., J. Biol. Chem., 2022)
がんと関連の深いN型糖鎖の枝分かれ構造についても研究を行っています。特に、GnT-Vと呼ばれる酵素が作るβ1,6分岐という枝分かれ構造は(図4上)、がんの増殖や転移を促進する働きがあることが以前から知られており、がんの創薬標的と考えられています。
私たちは、構造生物学の専門家(長江雅倫先生)と共同で、GnT-Vの立体構造を世界で初めて明らかにしました(図4左下)。その結果、GnT-Vがどのように糖鎖の形を認識してβ1,6構造を生合成するのか、そのメカニズムの基礎となる部分がわかってきました。この構造から、GnT-Vに選択的な阻害剤の開発が進むことが期待され、実際に有機化学の専門家との共同でGnT-Vの阻害剤の探索にも取り組んでいます。
一方で、細胞の中でGnT-Vがどのように特定のタンパク質を選んで糖鎖を作っているのか、その詳細な分子メカニズムはまだわかっていません。その手がかりとして、GnT-Vの中のNドメイン(図4右下)と呼ばれる領域が関わることがわかってきました。Nドメインを除いた変異体は、糖鎖に対する活性はほぼ完全に保持していたにもかかわらず、糖タンパク質に対する活性がほぼ消失していました。このことから、GnT-VはNドメインを介して糖タンパク質を認識する可能性が示されました。
現在は、GnT-Vが生体内で実際にどのようにタンパク質を認識するのかということや、GnT-Vの機能が制御される仕組みの解明に取り組んでいます。
COPDやがんに関わるコアフコースの研究
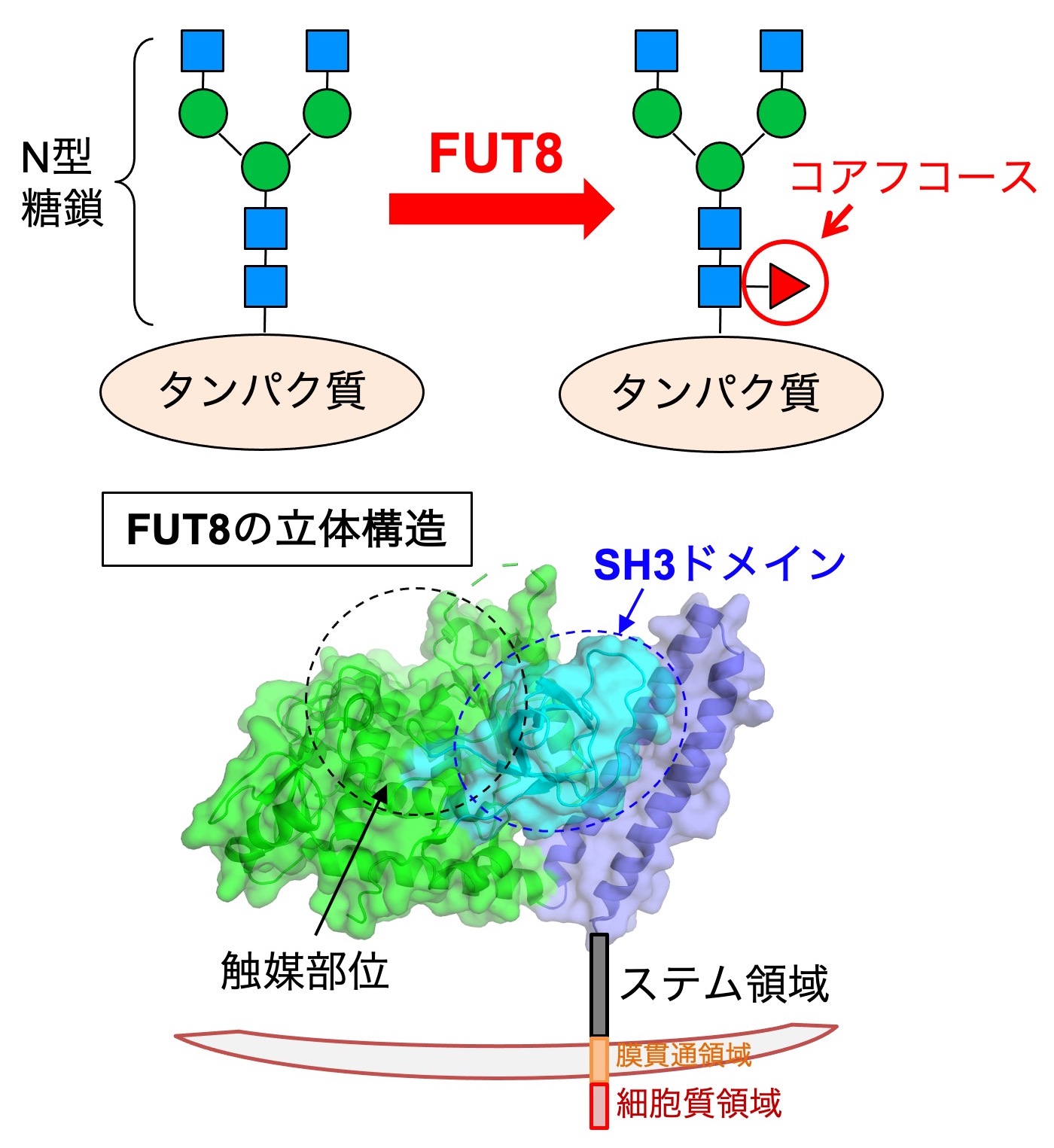
図5. (上) コアフコース構造と生合成酵素。(下) FUT8の立体構造。FUT8は、触媒部位の他にSH3ドメイン、ステム領域などを持つ。
(参考文献:Tomida et al., J. Biol. Chem., 2020)
また、N型糖鎖の根元のコアフコースと呼ばれる枝分かれ構造についても研究を行っています。コアフコースは、FUT8と呼ばれる酵素によって作られ(図5上)、FUT8欠損マウスが肺気腫様の症状を呈することから、慢性閉塞性肺疾患(COPD)と関わることが知られています。また、コアフコースは肺がんや皮膚がんの増殖や転移を促進することも報告されています。さらに、抗体医薬品の糖鎖からコアフコースを取り除いて抗がん作用を100倍近く上昇させる技術が臨床現場で用いられるなど、コアフコースはこれらの疾患の診断や治療と深く関わっています。このようにコアフコースの重要な機能が明らかになりつつある一方で、コアフコースを作るFUT8の機能がどのように制御されているのかはまだあまりよくわかっていません。私たちは、FUT8の立体構造や制御因子に着目して、FUT8の機能が細胞内でどのように制御されているのかを調べています。FUT8は立体構造がわかっており、糖鎖を合成する触媒部位の近傍に、他の糖転移酵素にはみられないSH3ドメインというユニークな領域を持ちます(図5下)。このSH3ドメインは、FUT8の酵素活性に不可欠であり、またFUT8がRPN1と呼ばれるタンパク質と結合することにも必要であることがわかりました。現在、FUT8とRPN1との結合の様式や意義についてさらに詳しく調べています。
糖尿病などに関わるGnT-IVの研究
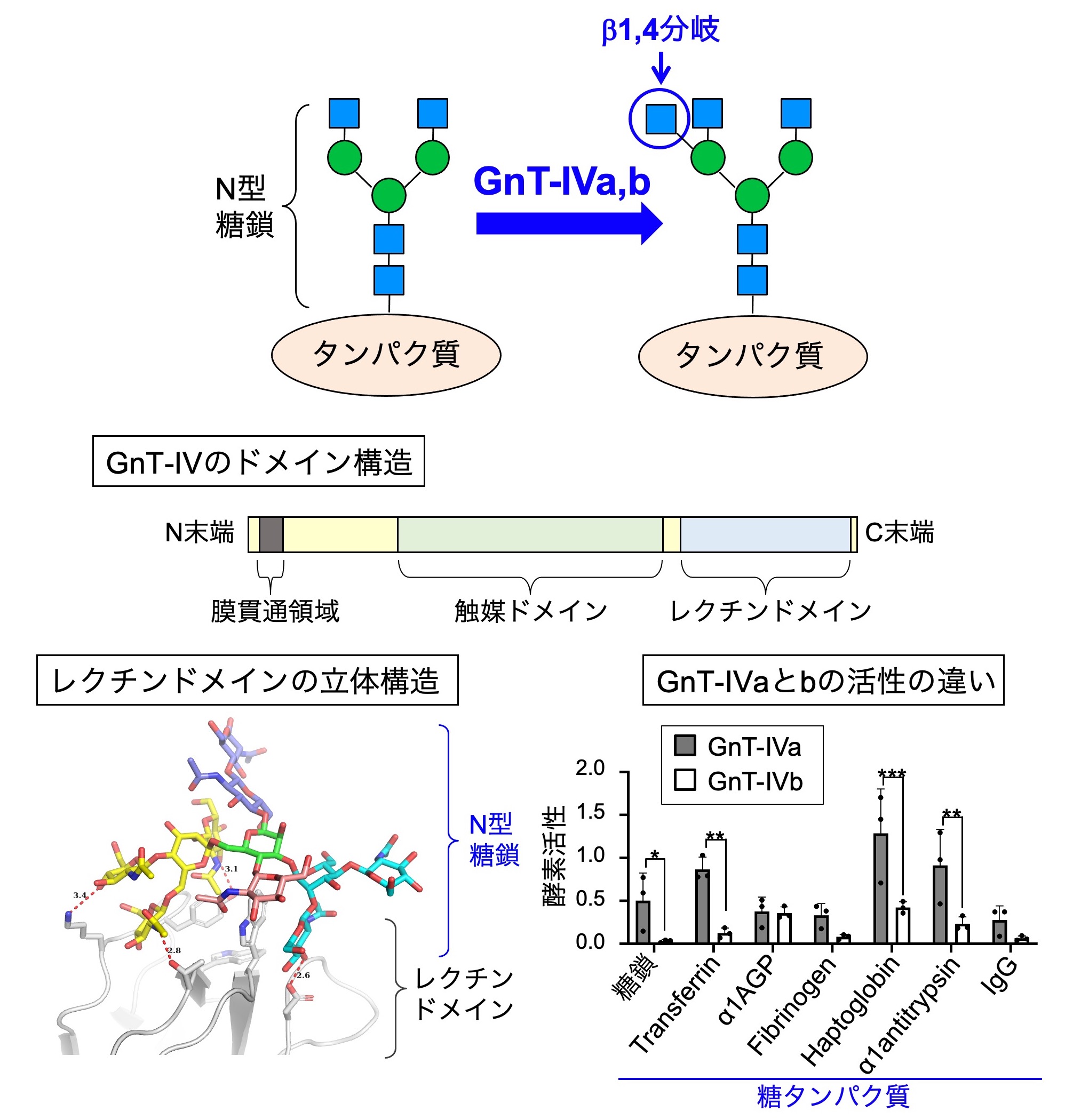
図6.(上) GnT-IVaとIVbが生合成するβ1,4分岐構造。(中) GnT-IVのドメイン構造。(左下) GnT-IVのレクチンドメインの立体構造。(右下) GnT-IVaとIVbの基質糖タンパク質に対する活性。
(参考文献:Nagae et al., Commun. Biol., 2022)
(参考文献:Osada et al., J. Biol. Chem., 2022)
さらに、糖尿病と関わるβ1,4分岐という枝分かれ構造についても研究を行っています。この枝分かれ構造は、GnT-IVa、GnT-IVbという2種類の類似した酵素によって生合成されています(図6上) 。GnT-IVaを欠損するマウスでは膵臓の機能が低下し、血糖値が高まって糖尿病様の症状を呈することから、この枝分かれ構造は糖尿病などの治療標的となることが示唆されています。一方で、GnT-IVaやIVbが細胞内においてどのような仕組みで糖鎖を作っているのか、またGnT-IVaとIVbという2つの類似した酵素の働きがどのように違うのか、ということについてはほとんどわかっていません。 最近私たちは、GnT-IVが他の糖鎖合成酵素とは異なるレクチンドメインというものを持っていることを明らかにしました(図6中)。さらにこのレクチンドメインは特定の糖鎖と結合し(図6左下)、これが触媒ドメインの糖鎖合成機能に不可欠であることがわかりました。これまでN型糖鎖を作る酵素の中でこのようなレクチンドメインを持つものは知られていないことから、GnT-IVは全く新しい様式で糖鎖を作ることが示唆されました。さらに最近、GnT-IVaとGnT-IVbについて、様々な糖タンパク質に対する活性を測定する系を確立して調べたところ、この2つの酵素は糖タンパク質基質の好みが大きく異なることがわかりました(図6右下) 。これは、この2つの類似した酵素がそれぞれ独自の機能を持つことを示しています。
疾患や脳機能と関連するその他の枝分かれ構造の研究
その他、疾患や脳機能と関連の深い糖鎖の枝分かれ構造についても研究を行っています。特に、GnT-IXと呼ばれる酵素が作る枝分かれ構造について研究しています。主に、これらの酵素の活性や機能が調節される分子メカニズムについて、国内外の共同研究者と連携しながら研究しています。
糖鎖検出プローブの開発
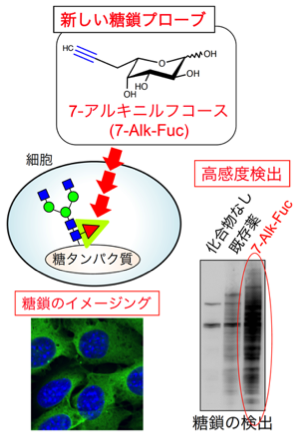
図7. 新しいフコースアナログによる糖鎖の高感度検出
(参考文献:Kizuka et al., Cell Chem. Biol., 2016)
糖鎖の研究をする上で、調べたい糖鎖を見ることは不可欠です。糖鎖を見るには、抗体やレクチンを使った手法が現在一般的ですが、私たちは、糖のアナログとクリックケミストリーを組み合わせて特定の糖鎖を検出する手法に着目しています。この手法をうまく使えば、細胞に糖アナログを添加するだけで簡単に糖鎖が検出できる可能性があります。一方で、この手法はまだ歴史が浅く、感度や特異性の面で問題が残されています。私たちはこれまでに、がんやCOPDと関連の深いフコース糖鎖を高感度に検出できる、新しいフコースアナログを開発しています(図7)。さらに、その他の糖鎖を検出する新しい糖鎖プローブの開発も行なっており、それらのプローブを使った創薬標的の探索や疾患の診断マーカーの開発を目指しています。
糖鎖の機能阻害剤の開発
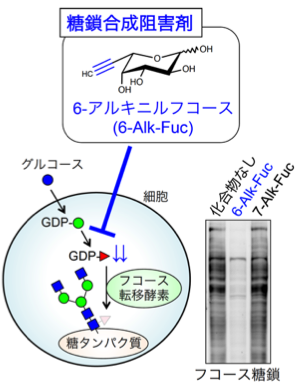
図8. 新しいフコース糖鎖合成阻害剤
(参考文献:Kizuka et al., Cell Chem. Biol., 2017)
研究によって糖鎖がどのように疾患に関連するかがわかっても、そのプロセスを外から調節できなければ疾患は治療できません。また、特定の糖鎖の機能や疾患との関わりを明らかにするためにも、その糖鎖の機能を調節できる方法が必要です。すなわち、特定の糖鎖の機能を阻害もしくは高める化合物が有用となります。私たちは、特に糖のアナログに着目し、特定の糖鎖の機能を阻害する化合物の開発を行っています。これまでに、フコース糖鎖の生合成を選択的に阻害するフコースアナログを発見し、その作用メカニズムを明らかにしました(図8)。この化合物は、がん細胞の浸潤能を抑えるなど、細胞の性質を変化させることもわかっています。また、岐阜大学の田中秀則先生らとの共同で、GnT-Vの阻害剤候補としての糖アナログの開発なども行っています(Vibhute et al., BBA Gen. Subj., 2022)。このように、新しい糖鎖の機能阻害剤の開発は、基礎研究と治療応用の両面に貢献すると考えられます。
その他の研究テーマ
GPI (Glycosyl Phosphatidyl Inositol)アンカーに関する研究
タンパク質に付加される糖脂質であるGPIの生合成と機能について、特にプリオン病や精神疾患との関連、またGPIアンカー型タンパク質の細胞内輸送などに関する研究を行っています(参考文献:Hirata et al., J. Biol. Chem., 2022)。
細胞外小胞 (sEV)と糖鎖に関する研究
細胞間の情報伝達の担い手として注目されるエクソソームなどの細胞外小胞における糖鎖の組成や役割について、鈴木健一研究室 (iGCORE) と共同で研究しています。
アルギニンメチル化と糖鎖に関する研究
翻訳後修飾の一つとして知られるタンパク質のアルギニン残基のメチル化と、糖鎖・糖タンパク質の発現、機能の関係について、岐阜大学応用生物科学部の橋本美涼先生と共同で研究しています(参考文献:Hashimoto et al., BBA Gen. Subj., 2020)。
HNK-1 (Human Natural Killer-1) 糖鎖に関する研究
記憶・学習能力に不可欠な脳特異的糖鎖であるHNK-1の生合成の調節の仕組みについて研究しています。これまでに、GnT-IIIによってHNK-1の生合成が抑制されること、またそれは組織特異性があることなどを明らかにしています(参考文献:Kawade et al., Molecules, 2021)。
