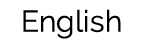「生命とは何か?」という問いに答えるためには、まず生命現象の歯車として働いている生体分子の各々の役割を正しく知る必要があります。これが、分子レベルの機能解明です。
生理活性物質学研究室では、糖鎖の役割を分子レベルで解明し、医薬へと応用することを大きな目標として、「糖鎖の化学合成」を主題として研究を進めています。
なぜ糖鎖なのか?糖鎖の計り知れないポテンシャルを引き出したい
脊椎動物の全ての細胞表面は、糖鎖で覆われています。細胞と外界の境界である細胞膜に糖鎖を含む分子が多数存在し、細胞の保護、外界と細胞の情報交換、物質交換などの生命活動の維持に不可欠な事柄に関わっています。その為、細胞核に存在する核酸(ヌクレオシドの鎖)と細胞質に存在する蛋白質(アミノ酸の鎖)に続いて糖鎖(糖の鎖)は「第三の生命鎖」と言われています。しかし、これらの仕組みは未解明の部分が殆どと言っていいほど、謎ばかりが存在します。もし、この仕組み解明が進めば、がん化、病原体(ウィルス、細菌、寄生虫)の感染、免疫異常、アルツハイマー病といった人類の脅威となる疾患に対する新たな医薬の開発へと発展することが期待できます。
糖鎖研究を阻むもの=多様性と微量性
残念ながら、「第三の生命鎖」である糖鎖の研究は、核酸、蛋白質と比べて遅れています。
それは、二つの理由によるものです。
- 生体に存在する糖鎖の種類が膨大(構造多様性)
- 生体に存在する糖鎖の量が大変少ない(微量性・稀少性)
つまり、重要だとわかっているけど、研究材料として手にできる糖鎖が不足または欠乏しているので、研究の進みが遅いという、もどかしい状況なのです。それでも、日本の糖鎖研究者は、世界をリードし続けています。では、研究したい糖鎖が自由に手に入るようになったら、どうなるでしょう?答えは明らかですね。
だから人工的に糖鎖を自在につくりたい! だから有機合成!
糖鎖研究の二つの壁を取り払うには、研究の対象となる混じりっ気のない糖鎖を沢山作る必要があります。
その目的には、有機合成が絶大な力を発揮します。ですが、体内にある糖鎖を全てつくるためには、まだまだ研究が必要です。
だからこそ、我々の研究室では、営々と研究を積み重ね、つくる技術を磨き続けています。
その結果、これまでは不可能だと言われてきた数々の糖鎖の合成に成功してきました。
「つくる」が始まり=つくる→機能を解明する→機能を応用する
合成技術を磨いた結果、つくれなかった糖鎖がつくれるようになり、それを使って多くの共同研究者が調べられなかった糖鎖の機能を調べられるようになり、未知の機能が明らかになり、機能を応用した研究ができるようになり、、、、と最終的に糖鎖の機能を応用した医薬へと展開していきます。
つまり、つくる技術をどこまで高められるかによって、我々が観ることのできる糖鎖の世界は変わるのです! そして、生命観も!!
糖鎖合成を極めて、糖鎖の世界を変えよう‼
- 糖鎖の斬新なつくり方を編み出す
- 世界で成功していない難関糖鎖をつくる
- 糖鎖の機能を解明するための特別仕様の糖鎖をつくる
- 医薬に応用するためのスマートな糖鎖をつくる
やる気のある人なら誰でも大歓迎です!
1-1.α選択的シアリル化法の開発
シアル酸は細胞表面の糖鎖に存在しており、細胞間のコミュニケーションにおいて重要な役割を果たします。また一方で、細菌やウイルスはシアル酸を有する糖鎖を標的に感染するため、医薬開発の対象として重要な分子です。シアル酸は二種類の結合様式(α結合・β結合)により他の分子と結合しますが、天然にはα結合のシアル酸のみが存在します。しかし、化学合成でα結合のシアル酸を作り分けることは極めて難しく、糖鎖合成化学における50年来の課題とされていました。我々は、β側に壁(架橋部)をもつ二環性シアル酸供与体を利用することによって、α結合のシアル酸のみを合成すること(完全なα選択的シアリル化)に初めて成功しました。この合成法によって、酸素原子を介した結合(O-グリコシド結合)のみならず、ワクチン開発に有用な、炭素原子を介した結合(C-グリコシド結合)をもつシアル酸も合成可能となりました。さらに、これまで困難であった、糖脂質やシアル酸オリゴマー(現時点で世界最長)の化学合成を達成しました。
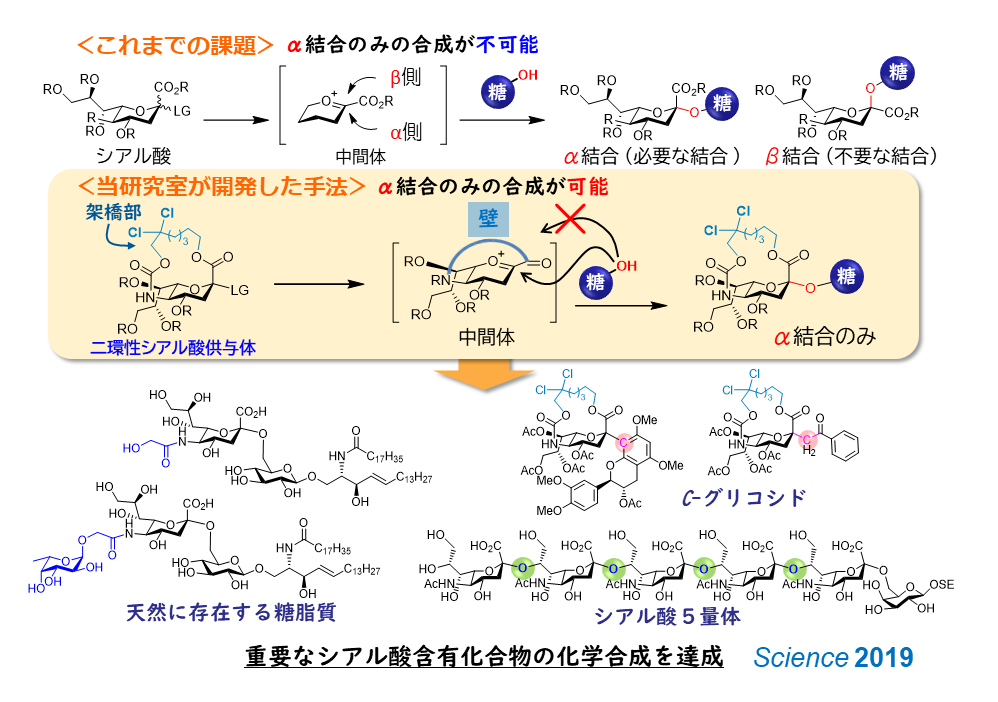
1-2.DTBS効果を利用したα選択的ガラクトシル化法の開発
糖鎖を化学合成するためには、アノマー位の立体化学(α、β)を精密に制御しなければなりません。そのためには、立体選択的にグリコシル化反応を行う必要があります。β選択的なグリコシル化反応は、隣接基効果を利用することで比較的容易に達成できます。一方で、α選択的なグリコシル化反応は、確立された汎用性の高い方法論が存在せず、糖化学における大きな課題の一つになっています。我々は、ガラクトースの4,6位にdi-tert-butylsilylene (DTBS) 基という保護基を導入した糖供与体を合成し、これをグリコシル化反応に供することで、高収率かつ高立体選択的にα-ガラクトシドを与える反応を開発しました(DTBS効果)。我々はこれまでに、この独自の手法を活用して、様々な生理活性糖鎖に含まれるα-ガラクトース構造の構築に成功しています。また、実験科学と計算科学(共同研究)を駆使し、当該反応の詳細な反応機構の解明も進めています。
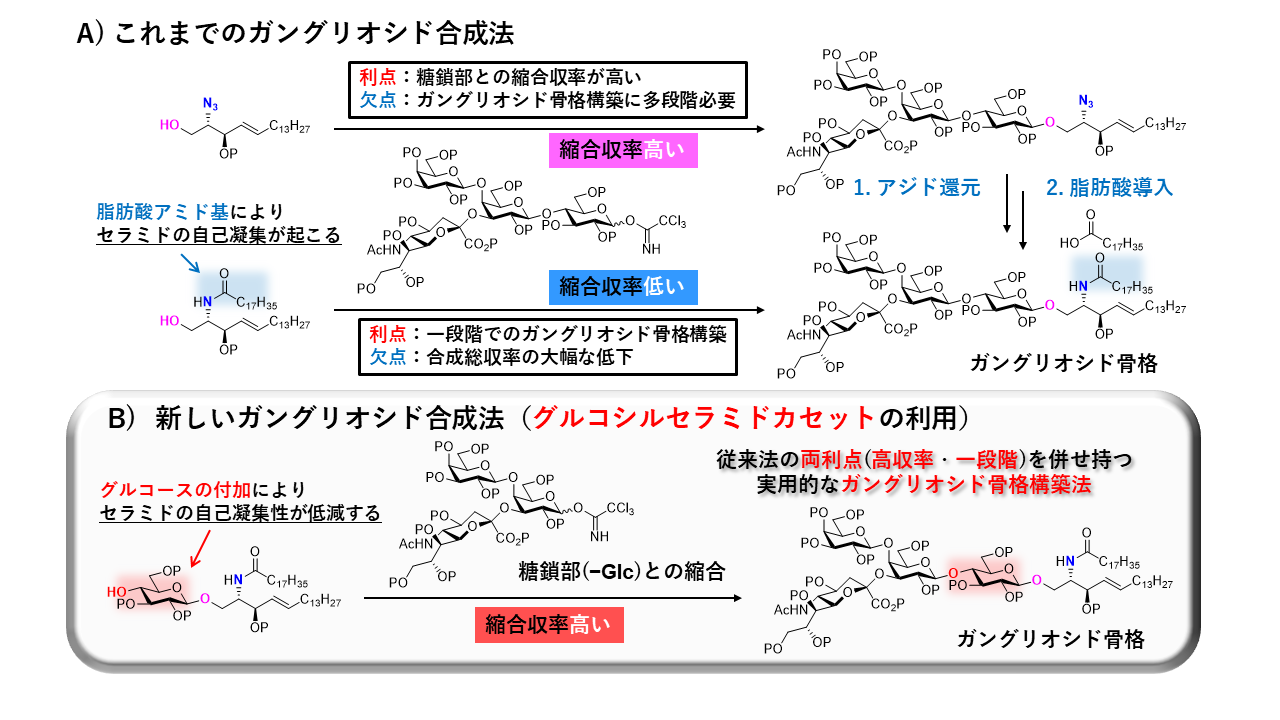
1-3.効率的なガングリオシド合成法の開発:グルコシルセラミドカセットアプローチ
我々の研究室ではシアル酸を含む糖鎖部とセラミド部から成るガングリオシドと呼ばれる生理活性糖脂質の完全化学合成を世界に先駆けて達成してきました。しかしながら、当時の合成法は糖鎖部構築後にセラミド部を多段階で導入していたため、苦労して構築した糖鎖を合成終盤で失うことが多く、決して合成効率の良いものではありませんでした(図A上)。また、糖鎖部とセラミド部を直接縮合する合成法も存在しましたが、セラミドの特異な化学構造に起因する水素結合・疎水性相互作用によってセラミド部が自己凝集してしまうため、糖鎖部との縮合収率が極めて低いものでした(図A下)。そこで我々は、ガングリオシド糖部還元末端に存在するグルコースをセラミド部に加えることで、自己凝集性を低減させたグルコシルセラミドカセットを開発しました(図B)。本カセットを用いることで、還元末端グルコースを除く糖鎖部との縮合でガングリオシド骨格を一段階かつ高収率で構築できるようになりました。
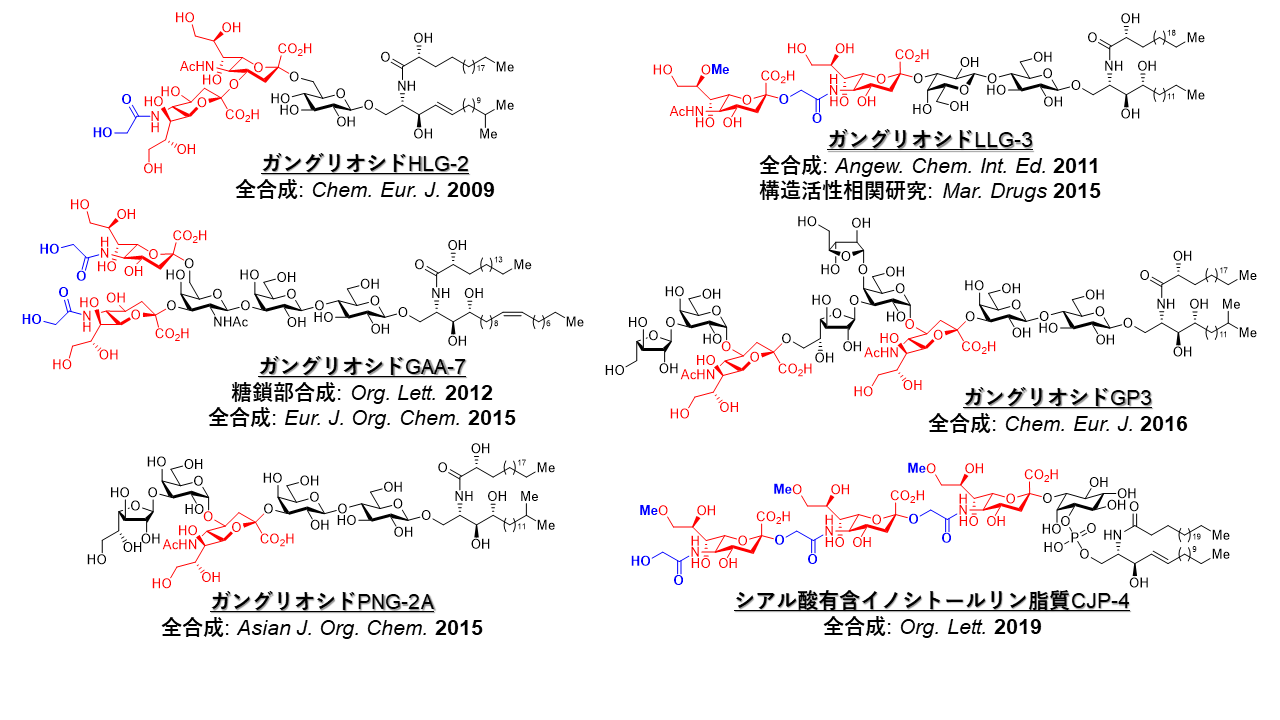
2.天然物合成:棘皮動物由来シアル酸含有糖脂質の全合成
ナマコやヒトデなどの棘皮動物から単離されたシアル酸含有糖脂質は強力な神経突起伸展活性を示すことが報告されています。また、それら糖脂質は哺乳動物由来ガングリオシドと異なり、内部にシアル酸を持つことやシアル酸が化学修飾されていること(N-グライコリル化・O-メチル化)など構造的特徴を有するため、生物学的だけでなく合成化学的にも非常に興味深い分子と言えます。そこで我々は、独自に開発したグリコシル化法と合成法を用いて、棘皮動物由来シアル酸含有糖脂質の全合成に挑戦してきました。これまでに下記に示す分子の全合成を達成しました。
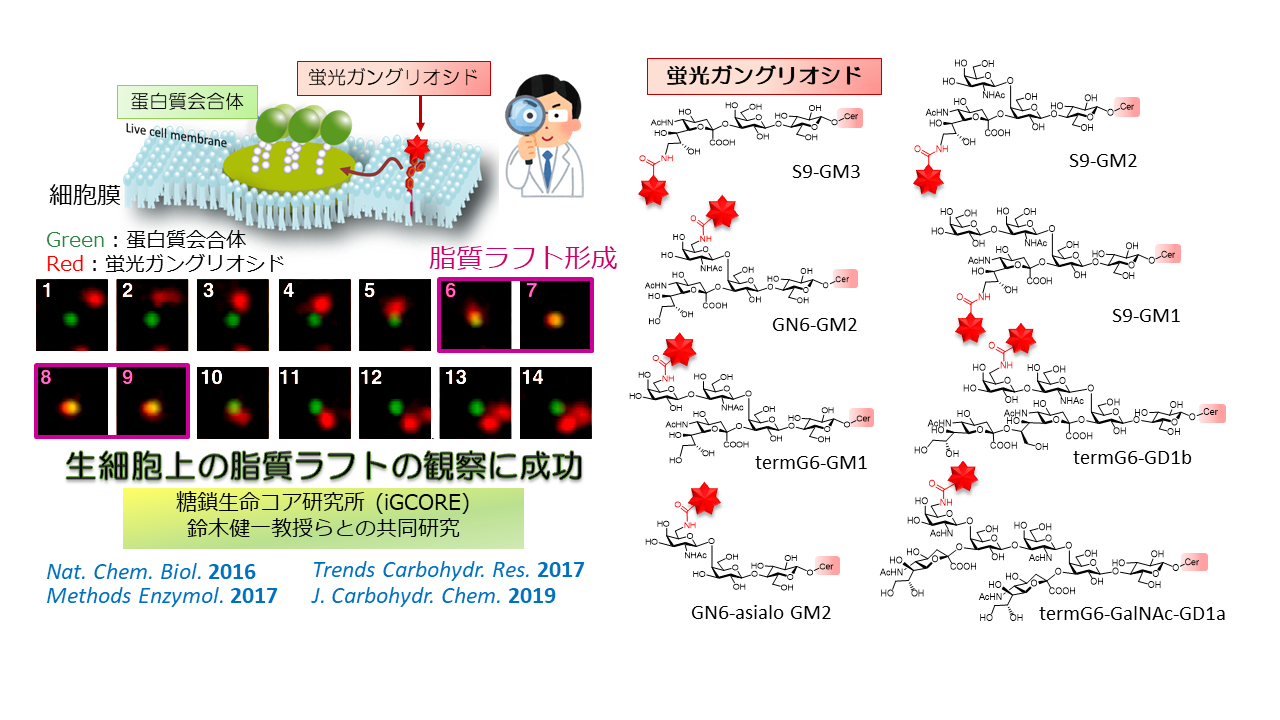
3.ガングリオシドプローブが切り開く細胞膜ケミカルバイオロジー研究
細胞膜上に存在するスフィンゴ糖脂質(ガングリオシド)は蛋白質受容体やコレステロールと共に集合体(脂質ラフト)を形成することによって細胞内外の重要なシグナル伝達を果たすと考えられています。しかしながら、脂質ラフトの存在自体に長年疑問がもたれていました。この問題を解決するためには、脂質ラフトを直接観察する方法が必要とされていました。我々は、蛍光ガングリオシドを開発することで、生細胞上のガングリオシドの観察(1分子イメージング)を可能とし、これによって脂質ラフトの形成過程の観察・脂質ラフトの存在証明に初めて成功しました。(岐阜大学 生命の鎖統合研究センター、鈴木健一教授らとの共同研究)これまでに、独自の化学合成法によって30種類以上の蛍光ガングリオシドを開発し、脂質ラフト形成や、ガングリオシドと蛋白質受容体の相互作用の解析を行ってきました。脂質ラフトはシグナル伝達のみならず、インフルエンザや癌など、重要な感染・疾患に深く関与すると考えられているため、これらの機構解明や医薬開発に貢献するための研究を進めています。
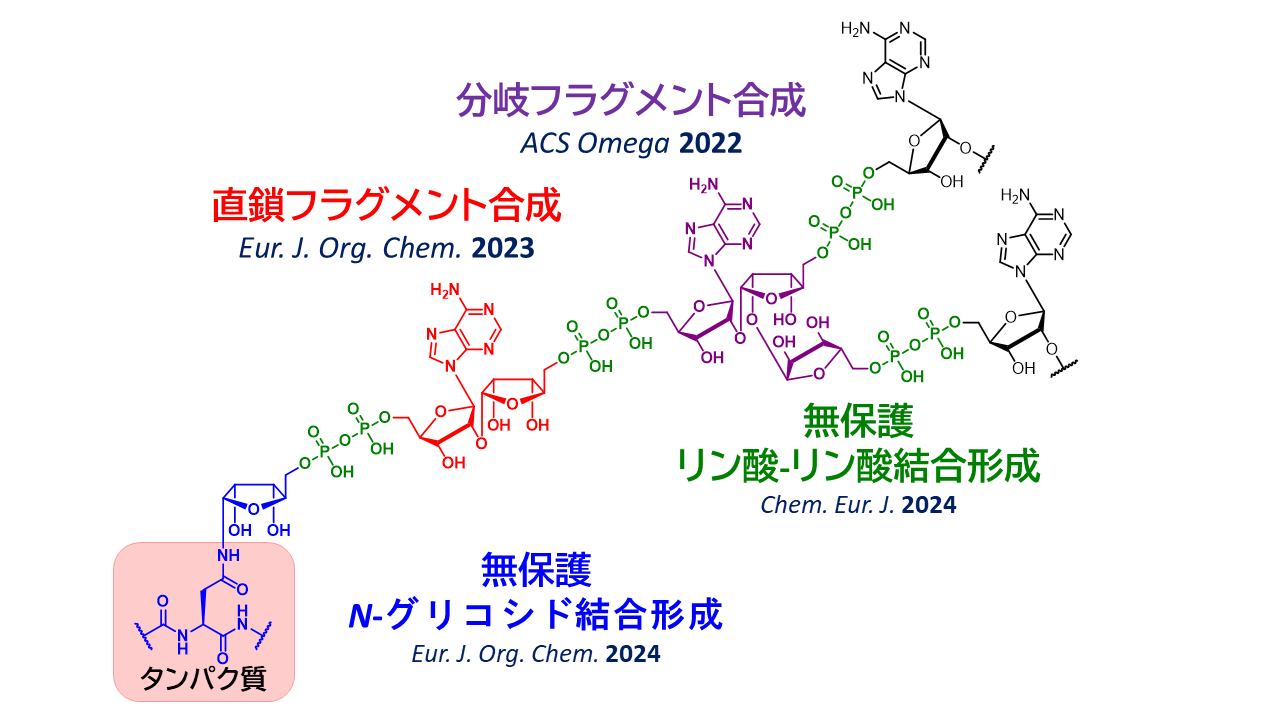
4.ADP-リボース鎖合成法の開発
ADP-リボース鎖は、糖鎖と同様にタンパク質の翻訳後修飾で付加される生体分子であり、DNA損傷修復に深く関与しています。その生物学的重要性に加え、糖鎖と核酸の構造的特徴を併せ持つことから、合成化学の観点からも魅力的な合成標的です。そこで我々は、ADP-リボース鎖を自在に合成することを目指し、糖鎖合成技術を基盤として直鎖および分岐フラグメント合成に成功しました。さらに、ADP-リボース鎖に含まれるリン酸-リン酸結合と還元末端N-グリコシド結合を効率的に形成する新しい方法を開発しました。これらの合成法を用いて、ADP-リボース鎖ケミカルバイオロジー研究を推進しています。