Top pageへ
研究紹介
創薬の重要なターゲットのひとつであるとして三量体GTP結合蛋白質共役型受容体(GPCR: Heterotrimeric GTP-binding protein coupled receptor)の細胞内情報伝達機構について、細胞をベースにして研究を行っております。特に、次にあげる二つの大きなテーマについて現在研究を進めております。ご興味のおありの方はいつでもご連絡ください。
テーマ1 細胞運動におけるGPCRシグナルによるRhoシグナルを介した細胞骨格制御機構の解明
がんの浸潤・転移といった病態における細胞運動には、異常にアクチン細胞骨格が制御されていると考えられる。一般的に、アクチン細胞骨格制御にRhoファミリー低分子量GTP結合蛋白質が重要な役割を担っていると考えられている。しかし、時間的、空間的な細胞骨格の制御をするためには、それらのRhoファミリー低分子量GTP結合蛋白質を緻密に制御する機構が必要となる。我々は以下の経緯から、細胞外シグナルの三量体GTP結合蛋白質共役型受容体を介したシグナルが、Rhoファミリー低分子量GTP結合蛋白質を制御することを見出した。この機構の詳細を知ることにより、がんの浸潤や転移、あるいは神経細胞の神経突起伸展に関わるような病態に対する新しい薬の開発に結びつくのではないかと考え、以下のように現在、研究を進めている。
研究の流れ
三量体G蛋白質シグナルによるアクチン細胞骨格制御
GPCRは、現在、遺伝子上1000種以上あると推定されます。基本的には、それぞれのGPCRに特異的なリガンドが結合することにより、細胞内で共役している三量体GTP結合蛋白質(G蛋白質)が情報変換器として働き、細胞内に種々のシグナルを送り込む。
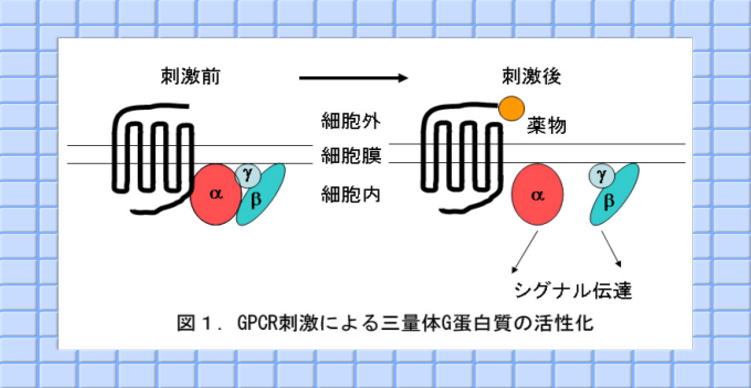
G蛋白質は、α, β, γの三つのサブユニットから構成されており、GPCRとリガンドの結合により、αサブユニット上で、GDPとGTPの交換反応が起こり、GTP結合型αサブユニットとβγサブユニットが解離し、それぞれが種々のエフェクター分子に結合し、そのエフェクターの作用を通じて、さまざまな細胞応答を引き起こすと考えられている。私たちのグループは過去、γサブユニットのサブファミリーの中で、γ12サブユニットがF-アクチンと結合することを見出し、報告した。また、このγ12のリン酸化が細胞遊走を増加させることも見出し、三量体G蛋白質シグナルがアクチン細胞骨格制御に関与していることが考えられた。そこで、発現プラスミドを用い、βγサブユニットを細胞内で共発現させた細胞内でのβγの機能について検討した。その結果、HeLa細胞にβγサブユニットを共発現させた場合、強いアクチンストレスファイバー構造を構築することがわかり、この構築に、低分子量GTP結合蛋白質の一つのファミリーであるRhoファミリー低分子量G蛋白質(Rho)のRhoAが関与していることを、Rhoファミリーの各種dominant negative変異体、恒常的活性化型変異体などを用い明らかにした。一方、NIH3T3線維芽細胞を用い、細胞伸展について検討した場合、三量体G蛋白質のGαi/oをADPリボシル化し、阻害する百日咳毒素(PTX)を処理した細胞では、細胞伸展が抑制されることがわかり、さらに各種遺伝子を用い検討した結果、この細胞伸展に、RacおよびCdc42が関与することを明らかにした。以上のことから、種々の細胞で、三量体G蛋白質シグナルの下流でRhoファミリー低分子量G蛋白質を制御することによるアクチン細胞骨格制御機構を介し、細胞形態決定機構の存在が示唆された。
二つのGサイクルを結ぶRhoGEF分子
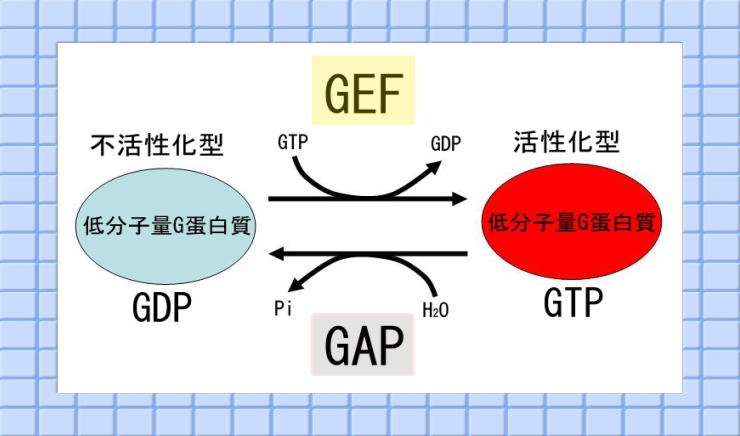
上記のように、三量体G蛋白質シグナルがRhoシグナルを制御する機構をさらに検討するため、Rhoを制御する分子に着目し研究を進めた。細胞内でRhoを制御する分子として考えらるのが、RhoのGDP結合型(不活性型)からGTP結合型(活性化型)へのグアニンヌクレオチドの交換を促進させる分子Rho特異的グアニンヌクレオチド交換因子(RhoGEF: Rho family specific GDP-GTP guanine nucleotide exchange factor)と、GTP結合型(活性化型)のRhoにおけるGTPの加水分解酵素活性を上昇させる分子Rho特異的GTPアーゼ活性化蛋白質(RhoGAP: Rho specific GTPase activating protein)である。
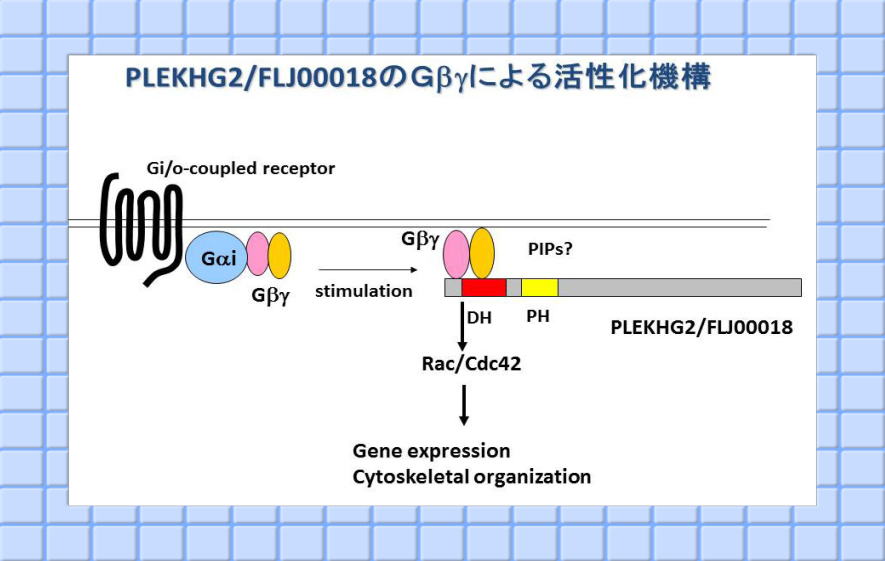
我々は、RhoGEFに着目し、研究を進めた。現在、RhoGEFは、構造上大きく二つのグループに大別されている。一つはGEF活性を担うとされるDbl homology(DH) domainと細胞膜リン脂質との相互作用に重要な役割を果たすと考えられているplecstrin homology (PH) domain をタンデムにもつDbl ファミリーRhoGEFと、Dock homology region (DHR)2 domainを持つCZH蛋白質ファミリーRhoGEFである。現在、ヒトで、DblファミリーRhoGEFは約70種、CZH蛋白質ファミリーRhoGEFは11種知られている。我々は特にDblファミリーRhoGEFに着目し研究を進めた。 DblファミリーRhoGEFは、一般的に、アミノ酸の一次構造からみる推定分子量が、60kDa以上ある高分子蛋白質がほとんどであり、多くの場合、DH domainとPH domainを持つ以外に、Src homology 2 (SH2) やPDZといった機能ドメインをもち、多機能蛋白質であることが考えらる。我々は、ヒト長鎖cDNA解析プロジェクト(HUGE:Human Unidentified Gene-Encorded Large Proteins)を進めていたかずさDNA研究所と共同研究を行い、βγサブユニットにより活性化される新規RhoGEFとしてFLJ00018/PLEKHG2を同定した。FLJ00018は、βγサブユニットと直接相互作用することにより、活性化され、RacおよびCdc42を活性化し、細胞伸展制御に関わることを明らかにした(Ueda et al. J Biol Chem. 2008)。
FLJ00018/PLEKHG2( pleckstrin homology domain containg ,family G(with RhoGef domain) member2)は、もともとHimmel et al. により急性骨髄性白血病のマウスモデルにおいて同定されてきたCLG(Common-Site Lymphoma/Leukemia Guanine Nucleotide Exchange Facto)のhuman homologである。マウスCLGから、白血病の発生に関わる遺伝子の一つと考えられるのと同時に、痙縮 に関わると考えられている。このようにFLJ00018は、種々の病態とかかわることが考えられ、その活性制御機構の詳細を知ることはきわめて重要であると考えた。
また、αsによって活性化されるRhoGEFとして、KIAA0424/h-PEM2/ARHGEF9も同定し、報告した。
FLJ00018/PLEKHG2の制御と細胞機能(最近の結果から)
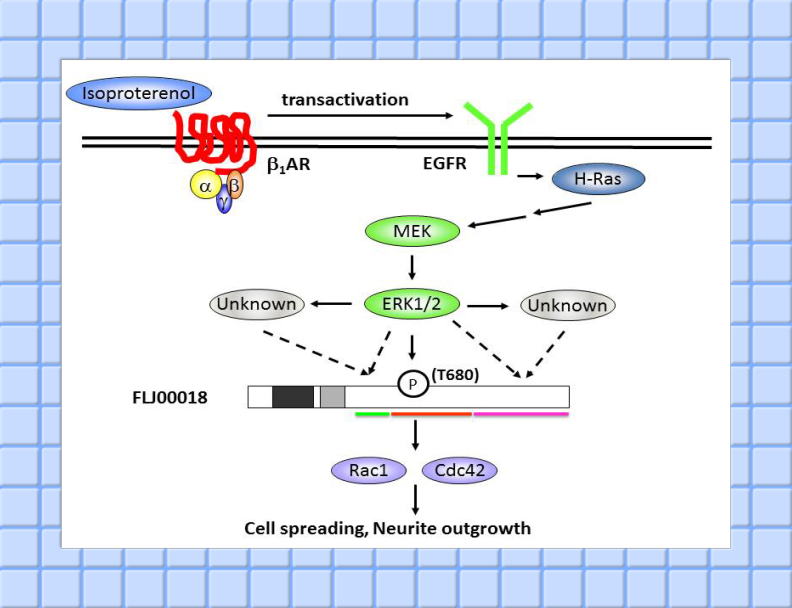
①上皮成長因子(EGF)受容体経路によるFLJ00018/PLEKHG2のトレオニン680のリン酸化による細胞形態の調節
β1アドレナリン受容体刺激で、transactivationの機構を介してEGF受容体経路を介し、FLJ00018/PLEKHG2が活性化されることが明らかになった。この活性化は、EGF受容体の直接的な刺激によっても引き起こされる。また、この時、FLJ00018/PLEKHG2はRas/MAPキナーゼ経路によりリン酸化されることも明らかになり、そのリン酸化サイトの一つが680番目のトレオニンであることが明らかになった。さらに、このリン酸化サイトのアラニン置換変異体を使用した結果、このリン酸化を介して、Neuro2a細胞において、細胞の形態変化が調節されることが示唆され、今後さらにこの機構についての詳細な検討が必要であると考えられた。(Sato et al. J Biol Chem 2014)
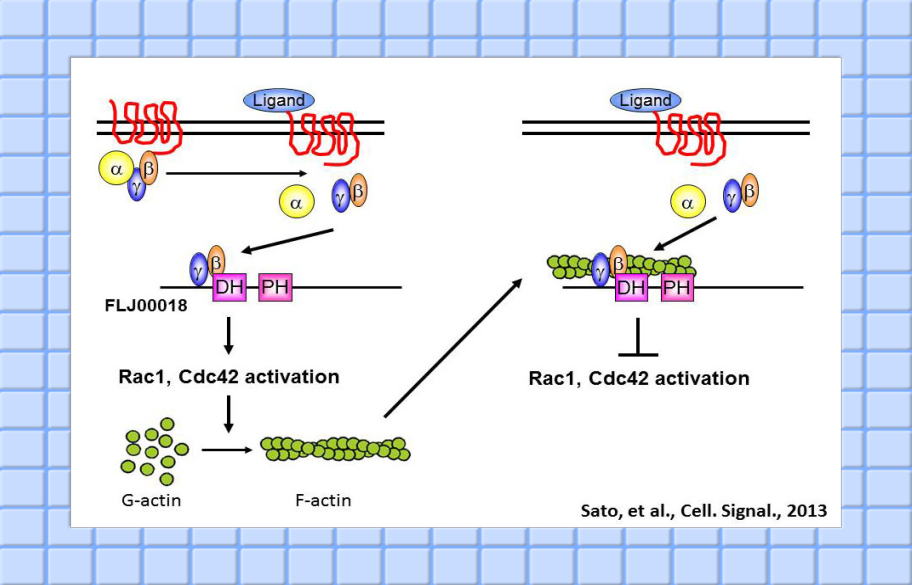
②アクチンとの相互作用がFLJ00018の活性を抑制する
我々は、生体内でFLJ00018がβγサブユニット以外の生体内分子と相互作用するのかどうかについて、酵母Two-hybrid法を用い解析を進めた。最近、その分子の一つとして、非筋細胞アクチンを同定した。アクチンはβγと異なった部位でFLJ00018と相互作用し、FLJ00018の活性を抑制することを明らかにした。この抑制機構では、活性化されたFLJ00018が、Rac及びCdc42の活性化を介して、GアクチンからFアクチンへの変化を導き、そのFアクチンが活性化されたFLJ00018に抑制的に働くようになると考えられる( Sato et al. Celluar Signalling 2013)。
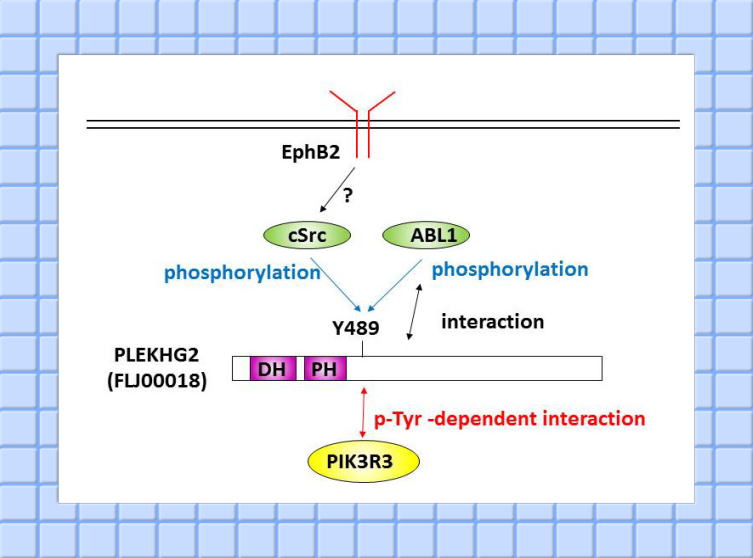
③EphB/Src経路によるFLJ00018のチロシンリン酸化を介する細胞内シグナル経路の同定
非受容体型チロシンキナーゼSrcにより、Asef等を含むいくつかのRhoGEFがチロシンリン酸化されると同時に、活性が制御されることが報告されている。そこでFLJ00018もSrcによるチロシンリン酸化を受けるかどうかを検討し、489番目のチロシンがリン酸化されることを明らかにした。また、一般的に、蛋白質のチロシンリン酸化は多くの蛋白質が持つSH2ドメインとの相互作用を介して、蛋白質-蛋白質相互作用を介して、細胞内シグナル伝達を制御することが知られている。そこで、各蛋白質のもつSH2ドメインを用いたSH2domain arrayを行い、FLJ00018の489番目のリン酸化チロシンと相互作用するSH2 domainをもつ蛋白質の同定を試みた。その結果、ABLとPI3KR3との相互作用が示唆され、このうちPI3KR3との相互作用はチロシンリン酸化依存的であることが示唆された。また、この時のSrcを活性化させるシグナル経路を探った結果、細胞同志の反発反応を制御する分子の一つであるEphrin受容体の中のEphB2の下流で、Srcを介して、FLJ00018がリン酸化されることを明らかにした。今後さらにこの経路がどのような細胞機能に関わるのかについて検討する必要があると考えられた( Sato et al. Celluar Signalling 2014)。
テーマ2 ヒト嗅覚受容体を利用した匂い受容の仕組みの解明
GPCRの遺伝子ファミリーの中で最大である嗅覚受容体は、ヒトにおいて約400種類存在することがわかっている。しかし、リガンドが明らかになっていない受容体がほとんどである。我々は、かずさDNA研究所と豊田中央研究との共同研究において、これらの受容体のリガンドを明らかにすることを目指している。最近、これらの受容体のうち、OR51E1がイソ吉草酸に強く反応することを見出し報告した。今後、さらリガンド-受容体の組み合わせを明らかにすることにより、我々の匂い環境をよくすることを目指している。